2018年1月18日,刘合力研究团队在国际学术期刊《自然·通讯》(Nature Communications)杂志上在线发表了题为“Structural basis of SALM5-induced PTPδdimerization for synaptic differentiation”的研究论文。该研究首次解析了自闭症相关糖蛋白SALM5及其与受体PTPδ的复合物的晶体结构,揭示了SALM5蛋白以二体为功能单位结合受体PTPδ并诱导神经突触分化的新机制。
自闭症(Autism),又称孤独症,是一种广泛发育障碍性疾病,以社会交往障碍、语言发育障碍、刻板重复的行为方式为基本临床特征,迄今为止其发病原因和致病机制仍不清楚。SALM5 (synaptic adhesion molecule 5) 是一种与自闭症谱系障碍(Autism Spectrum Disorders, ASDs) 相关的重要分子,可以通过结合受体酪氨酸磷酸酶(LAR-RPTPs) 家族成员从而诱导突触前膜的分化,在突触形成中扮演着重要角色。但SALM5与LAR-RPTP相互作用并诱导突触分化的机理尚未解决。
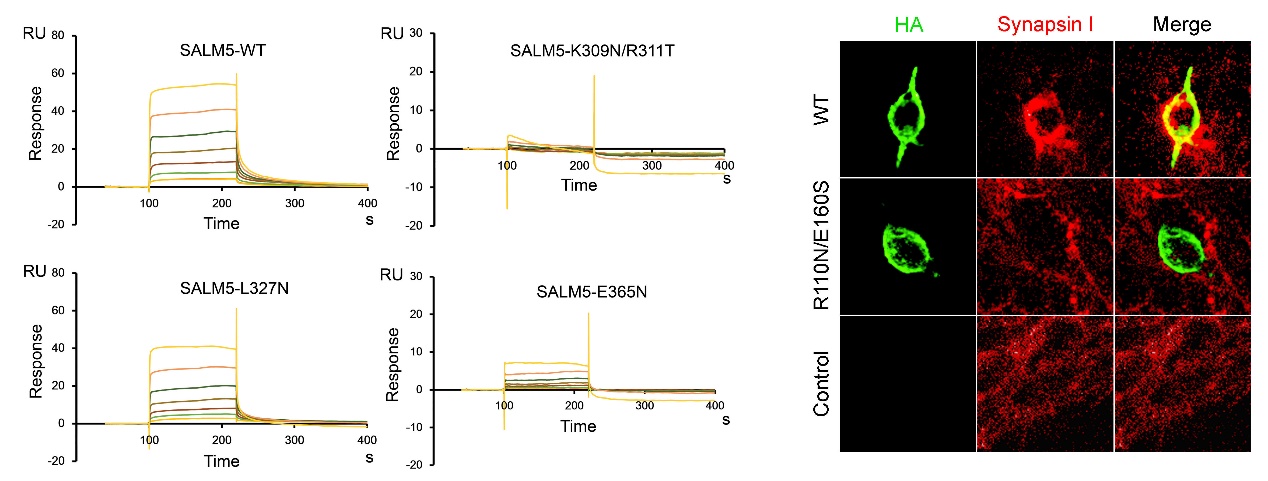
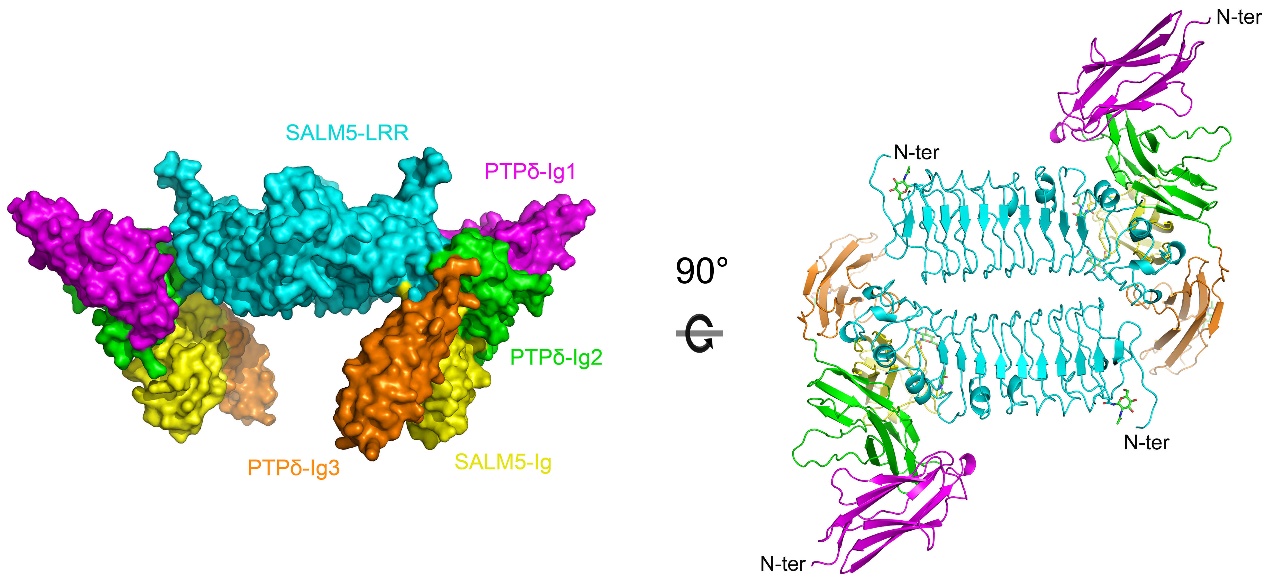
刘合力团队利用分子生物学手段及蛋白质X-射线晶体学技术解析了SALM5及SALM5/PTPδ复合物的晶体结构,直观地展示了SALM5及PTPδ在突触间的相互作用模式:区别于LAR-RPTPs受体家族的其他配体,两个SALM5分子主要通过LRR结构域反向平行堆积而形成具有二重对称性的二体;SALM5二体作为桥梁连接两个分开的PTPδ分子,从而形成化学计量比为2:2的异源四聚体。基于晶体结构,作者进一步设计了SALM5以及受体PTPδ的相关突变体,通过化学交联、超速离心分析及异源突触形成等实验证明了SALM5的二聚化是其发挥诱导突触分化功能的前提,并通过表面等离子体共振技术及细胞免疫荧光等实验发现并确证了蛋白相互作用的关键位点。该研究不仅首次解析了SALM蛋白家族成员的晶体结构,揭示了SALM5发挥生物学功能的基本单位,而且提出了受体PTPδ在神经突触分化中跨膜信号转导的新机制,这将为进一步确证SALM5/LAR-RPTPs信号复合体为自闭症的药物靶标奠定基础。
以上研究工作得到国家千人计划“青年千人”项目及北京大学“百人计划”项目的资助。六年制硕士研究生林兆晗为本论文的第一作者,北京大学药学院天然药物及仿生药物国家重点实验室为第一责任通讯单位。
论文链接:http://www.nature.com/articles/s41467-017-02414-2